4. Dacă tabelul nu conține o cifră corespunzătoare densității găsite, atunci aceasta din urmă se calculează prin interpolare folosind cele mai apropiate două valori.
De exemplu, densitatea soluției de HCI este de 1,032 g/ml.
Luați valori de densitate mai mari și mai mici decât cele măsurate și concentrațiile corespunzătoare. Gaseste diferentele:
Cu o creștere a densității cu 0,01 la sută de acid clorhidric crește cu 2%. Densitatea găsită este mai mică decât cea mai mare valoare cu 1,038 - 1,032 = 0,006. Aflați procentul corespunzător unei densități de 0,006:
X = (2 · 0,006): 0,01 = 1,2 (%).
Scăzând această valoare din cea mai mare valoare, obținem valoarea dorită:
8% - 1,2% = 6,8%.
5. Cunoscând procentul de HCl, se calculează volumul soluției concentrate (inițiale) care trebuie luat pentru prepararea unei soluții de HCl 0,1N. Volumul soluției inițiale se calculează folosind formula:
V – volumul soluției concentrate (inițiale) de HCl, ml;
С m – concentrația molară a soluției (С m = С N ·f), mol/l;
V c – volumul balonului cotat, ml;
M – greutatea moleculară a substanței, g/mol;
ρ - densitatea soluției inițiale, g/ml;
ω – concentrația procentuală a soluției inițiale, %.
De exemplu, trebuie să pregătiți 200 ml de soluție de HCI 0,1 N, apoi
Prin urmare, pentru a prepara 200 ml de 0,1 N (C m = 0,1 N 1, deoarece f = 1) soluție de HCI, trebuie să luați 10,4 ml de acid clorhidric cu o densitate de 1,032 g/ml.
5. Folosind o pipetă de măsurare, măsurați valoarea inițială calculată la cea mai apropiată zecime de ml. soluție concentrată HCl, se transferă într-un balon cotat cu volumul necesar și se aduce la semn cu apă distilată, astfel încât marginea inferioară a meniscului să atingă semnul.


6. Închideți balonul cu un dop și amestecați bine soluția, întorcând balonul de mai multe ori. Soluția astfel obținută este de aproximativ 0,1 N. Normalitatea exactă a unei astfel de soluții este stabilită prin teste titrimetrice.
7. Formalizați lucrarea. Formulați concluzii.
Autor: Enciclopedia chimică N.S. ZefirovACID CLORHIDRIC(acid clorhidric, acid clorhidric), soluție de HCI în apă, incoloră. lichid cu miros înțepător; acid ril monoprotic. Acid clorhidric HCI (gr. mol. 36,461) - incolor. gaz cu miros înțepător, fumează puternic în aer umed; Lungimea legăturii H-CI 0,1274 nm, m 3,716 10 -30 C m, energie de disociere 427,77 kJ/mol; punct de fierbere -85,1 °C (lichid incolor, ușor mobil), p.t. -114,22 °C; se cristalizează într-un cub. zăbrele, sub -174,15 °C există formă de romb. modificare; punct triplu -114,22 °C; densitatea aerului 1,2679; G crit 51,4°C, p crit 8,258 MPa, d crit 0,42 g/cm3; -92,31 kJ/mol, DH pl 1,9924 kJ/mol (-114,22°C), DH ex 16,1421 kJ/mol (-8,05°C), 186,79 J/(mol K); presiunea aburului (Pa): 133,32 10 -6 (-200,7 ° C), 2,775 10 3 (-130,15 ° C), 10,0 10 4 (-85,1 ° C), 74,0 10 4 (-40 ° C), 24,95 10 4 (О °С), 76,9 10 5 (50 °С); ecuația pentru dependența de temperatură a presiunii aburului logp(kPa) = -905,53/T+ 1,75lgT- -500,77 10 -5 T+3,78229 (160-260 K); factor de compresibilitate 0,00787; g 23 mN/cm (-155°C); r 0,29 10 7 Ohm m (-85°C), 0,59 10 7 (-114,22°C). Vezi și tabelul. 1. 
Solubilitatea HCl în hidrocarburi la 25 °C și 0,1 MPa (% mol): în pentan - 0,47, hexan - 1,12, heptan - 1,47, octan - 1,63. Solubilitatea HCI în halogenuri de alchil și arii este scăzută, de exemplu 0,07 mol/mol pentru C4H9CI. Solubilitatea în intervalul de la -20 la 60 ° C scade în seria dicloroetan-tri-cloretan-tetracloretan-tricloretilenă. Solubilitatea la 10°C într-un număr de alcooli este de aproximativ 1 mol/mol de alcool, în esterii acizilor carboxilici 0,6 mol/mol, în acizii carboxilici 0,2 mol/mol. În eteri, se formează aducti stabili R2O HCI. Solubilitatea HCl în topituri de clorură respectă legea lui Henry și este pentru KCl 2,51 10 -4 (800 °C), 1,75 10 -4 mol/mol (900 °C), pentru NaCl 1,90 10 -4 mol/mol (900 °C). ).
Acid clorhidric. Dizolvarea HCl în apă este un proces extrem de exo-termodinamic, pentru o soluție apoasă infinit diluată D H 0 dizolvarea HCl este de 69,9 kJ/mol, ionul Cl este de 167,080 kJ/mol; HCl din apă este complet ionizat. Solubilitatea HCl în apă depinde de temperatură (Tabelul 2) și de presiunea parțială a HCl în amestecul de gaze. Densitatea acidului clorhidric k. diferite concentrații și h la 20 °C sunt prezentate în tabel. 3 și 4. Odată cu creșterea temperaturii h ACID HORICAL temperatura scade, de exemplu: pentru 23,05% ACID HORICAL temperatura la 25 °C h 1364 mPa s, la 35 °C 1,170 mPa s.S. K. care conține h moli de apă per 1 mol de HCl este [kJ/(kg K)]: 3,136 (n = 10), 3,580 (n = 20), 3,902 (n = 50), 4,036 (n = 100), 4,061 (n = 200).



![]()
HCI formează un amestec azeotrop cu apa (Tabelul 5). În sistemul HCl-apă există trei eutectice. puncte: - 74,7 °C (23,0% în greutate HCI); -73,0°C (26,5% HCI); -87,5°C (24,8% HCI, fază metastabilă). Sunt cunoscuți hidrați cristalini HCl nH 2 O, unde n = 8, 6 (punct de topire -40 ° C), 4, 3 (punct de topire -24,4 ° C), 2 (punct de topire -17,7 ° C) și 1 ( punct de topire -17,7 ° C) -15,35°C). Gheața cristalizează din acid clorhidric 10% la -20, de la 15% la -30, de la 20% la -60 și de la 24% la -80°C. Solubilitatea halogenurilor metalice scade odată cu creșterea concentrației de HCI în acidul clorhidric, care este utilizat pentru sărarea lor.
Proprietăți chimice. HCI pur uscat începe să se disocieze peste 1500°C și este pasiv din punct de vedere chimic. Mn. metalele, C, S, P nu interacționează nici măcar cu HCl lichid. Reacţionează cu nitruri, carburi, boruri, sulfuri peste 650 °C, cu hidruri de Si, Ge şi In-in prezenta AlCl 3, cu oxizi de metal de tranziție - la 300 °C și mai sus. O 2 și HNO 3 se oxidează la Cl 2, cu SO 3 dă ClSO 3 H. Pentru reacțiile cu compuși organici, vezi Hidrohalogenare.
ACIDUL HORICAL este foarte activ din punct de vedere chimic. Se dizolvă odată cu eliberarea de H 2 toate metalele care sunt negative. potential normal, cu multi oxizi si hidroxizi metalici formeaza cloruri, elibereaza acizi liberi din saruri precum fosfati, silicati, borati etc.
Chitanță.În industrie, HCl se obține prin următoarele metode: sulfat, sintetic. și din gazele de eșapament (gaze secundare) ale unui număr de procese. Primele două metode își pierd sensul. Astfel, în SUA în 1965 ponderea deșeurilor de acid clorhidric era de 77,6% din producția totală, iar în 1982 era de 94%.
Producerea acidului clorhidric (reactiv, obținut prin metoda sulfatului, sintetic, gaz rezidual) constă în obținerea de HCl cu absorbția ulterioară a acestuia de către apă. În funcție de metoda de îndepărtare a căldurii de absorbție (atinge 72,8 kJ/mol), procesele se împart în izotermodinamice, adiabatice. și combinate.
Metoda sulfatului se bazează pe interacțiunea NaCl cu conc. H2S04 la 500-550°C. Reacţie gazele conțin de la 50-65% HCl (cuptoare cu mufă) până la 5% HCl (reactor cu pat fluidizat). Se propune înlocuirea H2SO4 cu un amestec de SO2 și O2 (temperatura procesului este de aproximativ 540 °C, catalizatorul este Fe2O3).
Sinteza directă a HCl se bazează pe o reacție în lanț de ardere: H 2 + Cl 2 2HCl + 184,7 kJ.Constanta de echilibru K p se calculează prin ecuația: log K p = 9554/T- 0,5331g T+ 2,42.
Reacția este inițiată de lumină, umiditate, solid poros (cărbune, Pt poros) și anumite substanțe minerale (cuarț, argilă). Sinteza se realizează cu un exces de H2 (5-10%) în camere de ardere din oțel, grafit, cuarț și cărămidă refractară. Naib. material modern care previne contaminarea cu HCl, grafit, impregnat fenol-formal. rășini. Pentru a preveni arderea explozivă, reactivii sunt amestecați direct în flacăra arzătorului. În partea de sus. Schimbătoarele de căldură sunt instalate în zona camerei de ardere pentru a răci gazele de reacție la 150-160°C. Capacitatea cuptoarelor moderne de grafit ajunge la 65 de tone/zi (în termeni de acid clorhidric 35%). În caz de deficiență de H2 se folosesc diverse modificări ale procesului; de exemplu, treceți un amestec de Cl 2 cu vapori de apă printr-un strat de cărbune fierbinte poros:
2Cl2 + 2H2O + C: 4HCI + CO2 + 288,9 kJ
Temperatura procesului (1000-1600 °C) depinde de tipul de cărbune și de prezența impurităților în el care sunt catalizatori (de exemplu, Fe 2 O 3). Este promițător să folosiți un amestec de CO și vapori de apă:
CO + H2O + CI2: 2HCI + CO2
Peste 90% din acidul clorhidric din țările dezvoltate este obținut din deșeurile de HCl formate în timpul clorării și dehidroclorării compușilor organici, piroliza deșeurilor organoclorurate, clorurile metalice și producția de potasiu neclorurat. îngrășăminte etc. Gazele de eșapament conțin diferite cantități de HCl, impurități inerte (N 2, H 2, CH 4), substanțe organice slab solubile în apă (clorobenzen, clormetan), substanțe solubile în apă (acid acetic, cloral), impurități acide (Cl 2 , HF , O 2) și apă. Utilizarea absorbției izotermodinamice este recomandată la un conținut scăzut de HCl în gazele reziduale (dar la un conținut de impurități inerte mai mic de 40%). Naib. Absorbantele de film sunt promițătoare, făcând posibilă extragerea de la 65 până la 85% HCI din gazul de evacuare inițial.
Naib. Schemele adiabatice sunt utilizate pe scară largă. absorbţie. Abgazele sunt introduse în partea inferioară parte a absorbantului, iar apa (sau acidul clorhidric diluat) curge în contracurent în cel superior. Acidul clorhidric este încălzit până la punctul de fierbere datorită căldurii de dizolvare a HCI. Modificarea temperaturii de absorbție și a concentrației de HCl este prezentată în Fig. 1. Temperatura de absorbție este determinată de punctul de fierbere al acidului concentrației corespunzătoare (temperatura maximă este punctul de fierbere al amestecului azeotrop - aproximativ 110 ° C).
Pe fig. 2 prezintă un circuit adiabatic tipic. absorbția HCl din gazele reziduale formate în timpul clorării (de exemplu, producția de clorbenzen). HCI este absorbit în absorbantul 1, iar resturile de substanțe organice slab solubile în apă sunt separate de apă după condensare în aparatul 2, purificate în continuare în coloana de coadă 4 și separatoare 3, 5 și se obține acid clorhidric comercial.

Orez. 1. Schema de distribuție a temperaturilor (curba 1) și concentrației (curba 2) de HCl de-a lungul înălțimii adiabatice. absorbant.

Fig.2. Circuit adiabatic tipic. absorbţia HCl din gazele de evacuare: 1-adiabatic. absorbant; 2 - condensator; 3, 5-separatoare; 4-coloană de coadă; 6-colector faza organica; colector cu 7 fază apoasă; 8, 12 pompe; 9-coloana de stripare; 10-schimbator de caldura; 11-colectare de acid comercial.
Pe fig. 3 prezintă o schemă tipică pentru obținerea acidului clorhidric din gazele reziduale folosind o combinație. scheme de absorbtie. În coloana adiabatică. absorbtie primesc ACID HORRICALE la. mai mici. concentrație, dar lipsită de impurități organice ACID HORICAL cu crescut. concentrația de HCl este produsă într-o coloană de absorbție izotermodinamică la o scădere. temperaturile. Gradul de extracție a HCl din gazele de eșapament este de 95-99% (când se utilizează acizi diluați ca absorbant) și aproape complet când se folosește apă pură.
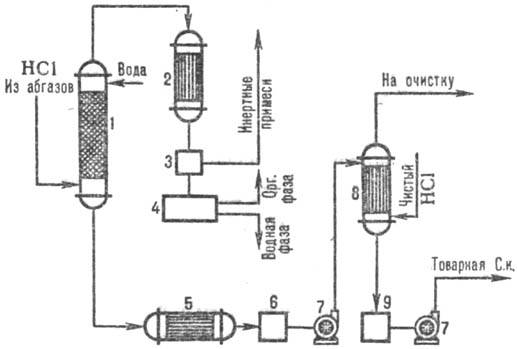
Orez. 3. Diagrama de combinație tipică. absorbtia HCl din gazele de evacuare: 1 - coloana adiabatica. absorbţie; 2 - condensator; 3-separator de gaze; 4-separator; 5-frigider; colectoare 6,9-acizi; 7-pompe; 8-absorbant izotermodinamic.
HCl se determină în aer nefelometric cu formarea de AgCl.
Acidul clorhidric se folosește la obținerea clorurilor de Mn, Fe, Zn etc., pentru decaparea metalelor, curățarea suprafețelor vaselor, puțurilor de carbonați, prelucrarea minereurilor, la producerea cauciucurilor, glutamat de Na, sodă, Cl 2 etc. Consumul de acid clorhidric în Japonia (mii de tone); industria chimică 320,7, producția de glutamat de Na 99,8, producția de sodă 54,8, metalurgia feroasă 50,0, industria celulozei și hârtiei 22,2, altele 80. HCI este utilizat pentru regenerarea Cl 2, în sinteza organică (producția de clorură de vinil, cloruri de alchil etc.) ca un catalizator (de exemplu, în producerea difenilolpropanului, alchilarea benzenului).
Producția de acid clorhidric 31% în URSS este de 1,52 milioane de tone (1986). HCI și acidul clorhidric sunt toxice, provoacă arsuri grave ale mucoaselor, sufocare, distrug dinții etc. Concentrația maximă admisă de HCl în aerul zonei de lucru este de 5,0 mg/m3.
Literatură: Yakimenko L.M., Pasmanik M.I., Manual privind producția de clor, sodă caustică și produse cu clor de bază, ed. a II-a, M., 1976; Levinsky M.I., Mazanko A.F., Novikov I.N., Acid clorhidric și acid clorhidric, M., 1985. A.I. Torubarov.
Enciclopedie chimică. Volumul 4 >>
| Densitate, g/ml | Conținut de masă, % | Densitate, g/ml | Conținut de masă, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | 1,108 | ||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Dacă tabelul nu conține o cifră corespunzătoare densității găsite, atunci aceasta din urmă se calculează prin interpolare folosind cele mai apropiate două valori.
De exemplu, densitatea soluției de HCI este de 1,032 g/ml.
Luați valori de densitate mai mari și mai mici decât cele măsurate și concentrațiile corespunzătoare. Gaseste diferentele:
Cu o creștere a densității cu 0,01, procentul de acid clorhidric crește cu 2%. Densitatea găsită este mai mică decât cea mai mare valoare cu 1,038 - 1,032 = 0,006. Aflați procentul corespunzător unei densități de 0,006:
X = (2 · 0,006): 0,01 = 1,2 (%).
Scăzând această valoare din cea mai mare valoare, obținem valoarea dorită:
8% - 1,2% = 6,8%.
5. Cunoscând procentul de HCl, se calculează volumul soluției concentrate (inițiale) care trebuie luat pentru prepararea unei soluții de HCl 0,1N. Volumul soluției inițiale se calculează folosind formula:
V – volumul soluției concentrate (inițiale) de HCl, ml;
С m – concentrația molară a soluției (С m = С N ·f), mol/l;
V c – volumul balonului cotat, ml;
M – greutatea moleculară a substanței, g/mol;
ρ - densitatea soluției inițiale, g/ml;
ω – concentrația procentuală a soluției inițiale, %.
De exemplu, trebuie să pregătiți 200 ml de soluție de HCI 0,1 N, apoi
Prin urmare, pentru a prepara 200 ml de 0,1 N (C m = 0,1 N 1, deoarece f = 1) soluție de HCI, trebuie să luați 10,4 ml de acid clorhidric cu o densitate de 1,032 g/ml.
5. Cu ajutorul unei pipete de măsurare, măsurați soluția concentrată inițială calculată de HCl cu o precizie de zecimi de ml, transferați-o într-un balon cotat cu volumul necesar și aduceți-o la semn cu apă distilată, astfel încât marginea inferioară a meniscului atinge semnul.


6. Închideți balonul cu un dop și amestecați bine soluția, întorcând balonul de mai multe ori. Soluția astfel obținută este de aproximativ 0,1 N. Normalitatea exactă a unei astfel de soluții este stabilită prin teste titrimetrice.
7. Formalizați lucrarea. Formulați concluzii.
Lucrul 2. Determinarea normalității soluției de lucru de HCI
Pentru soluție de NaOH 0,1 N
Sarcina postului: familiarizarea cu tehnica analizei titrimetrice, i.e. determinarea concentraţiei soluţiei de lucru din soluţia titrată.
Echipamente, reactivi: Soluție de lucru HCl, soluție titrata de NaOH, fenolftaleină, balon conic de 250 ml (sau alt volum la discreția profesorului), pipete de măsurare, biuretă, bulb.
Finalizarea lucrarii:
 1. Biureta se umple cu soluția de lucru HCI de testare. Se pipetează 5 ml dintr-o soluție de NaOH 0,1 N într-un balon de titrare, se adaugă 1-2 picături de fenolftaleină și se titrează prin picurare cu o soluție acidă până când culoarea purpurie dispare. La titrare, conținutul balonului este agitat cu mișcări de rotație sau cu un agitator magnetic.
1. Biureta se umple cu soluția de lucru HCI de testare. Se pipetează 5 ml dintr-o soluție de NaOH 0,1 N într-un balon de titrare, se adaugă 1-2 picături de fenolftaleină și se titrează prin picurare cu o soluție acidă până când culoarea purpurie dispare. La titrare, conținutul balonului este agitat cu mișcări de rotație sau cu un agitator magnetic.
 2. Folosind cântarul de biuretă se înregistrează consumul de soluție de HCl (V HCl, ml) utilizată pentru titrarea cu 5 ml de NaOH. Titrarea se repetă de 2-3 ori, fiecare titrare repetată începe cu o citire zero pe biuretă.
2. Folosind cântarul de biuretă se înregistrează consumul de soluție de HCl (V HCl, ml) utilizată pentru titrarea cu 5 ml de NaOH. Titrarea se repetă de 2-3 ori, fiecare titrare repetată începe cu o citire zero pe biuretă.
Pe baza volumului mediu de acid utilizat pentru titrarea alcalii, normalitatea acestuia este calculată folosind formula:
![]()
3. Formalizați lucrarea. Formulați concluzii.
Lucrarea 3. Formațiuni arborescente
Sarcina postului: familiarizarea cu conceptul de osmoză și presiune osmotică. Pentru a studia esența fenomenului de hemoliză.
 Echipamente, reactivi: stativ cu eprubete, solutie de adeziv silicat, cristale de sare: fier, cupru, mangan, nichel, cobalt etc. (cloruri, bromuri, nitrati).
Echipamente, reactivi: stativ cu eprubete, solutie de adeziv silicat, cristale de sare: fier, cupru, mangan, nichel, cobalt etc. (cloruri, bromuri, nitrati).
Finalizarea lucrarii:
1. O serie de eprubete sunt umplute cu o soluție de clei de silicat și cristale de sare sunt aruncate în eprubete. După ceva timp, din cristale cresc formațiuni asemănătoare copacilor.
2. Dați o explicație pentru fenomenul observat.
| Densitate, g/ml | Conținut de masă, % | Densitate, g/ml | Conținut de masă, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | … 1,108 |
||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Dacă tabelul nu conține o cifră corespunzătoare densității găsite, atunci aceasta din urmă se calculează prin interpolare folosind cele mai apropiate două valori.
De exemplu, densitatea soluției de HCI este de 1,032 g/ml.
Luați valori de densitate mai mari și mai mici decât cele măsurate și concentrațiile corespunzătoare. Gaseste diferentele:
Cu o creștere a densității cu 0,01, procentul de acid clorhidric crește cu 2%. Densitatea găsită este mai mică decât cea mai mare valoare cu 1,038 - 1,032 = 0,006. Aflați procentul corespunzător unei densități de 0,006:
X = (2 · 0,006): 0,01 = 1,2 (%).
Scăzând această valoare din cea mai mare valoare, obținem valoarea dorită:
8% — 1,2% = 6,8%.
5. Cunoscând procentul de HCl, se calculează volumul soluției concentrate (inițiale) care trebuie luat pentru prepararea unei soluții de HCl 0,1N. Volumul soluției inițiale se calculează folosind formula:
V – volumul soluției concentrate (inițiale) de HCl, ml;
С m – concentrația molară a soluției (С m = С N ·f), mol/l;
V c – volumul balonului cotat, ml;
M – greutatea moleculară a substanței, g/mol;
ρ—densitatea soluției inițiale, g/ml;
ω – concentrația procentuală a soluției inițiale, %.
De exemplu, trebuie să pregătiți 200 ml de soluție de HCI 0,1 N, apoi
Prin urmare, pentru a prepara 200 ml de 0,1 N (C m = 0,1 N 1, deoarece f = 1) soluție de HCI, trebuie să luați 10,4 ml de acid clorhidric cu o densitate de 1,032 g/ml.
5. Cu ajutorul unei pipete de măsurare, măsurați soluția concentrată inițială calculată de HCl cu o precizie de zecimi de ml, transferați-o într-un balon cotat cu volumul necesar și aduceți-o la semn cu apă distilată, astfel încât marginea inferioară a meniscului atinge semnul.


6. Închideți balonul cu un dop și amestecați bine soluția, întorcând balonul de mai multe ori. Soluția astfel obținută este de aproximativ 0,1 N. Normalitatea exactă a unei astfel de soluții este stabilită prin teste titrimetrice.
7. Formalizați lucrarea. Formulați concluzii.
